Avenir des traitements de la toux
Simulateur de Traitements Anti-Toux
Entrez vos paramètres et cliquez sur "Simuler l'efficacité du traitement" pour voir les résultats.
Conseil :
Les nouveaux traitements ciblent des récepteurs spécifiques comme TRPV1 ou NGF, avec moins d'effets secondaires que les opioïdes classiques.
La toux est un réflexe de protection qui évacue les sécrétions et les irritants des voies aériennes. Aujourd'hui, les solutions pharmaceutiques restent largement symptomatiques, mais la recherche pointe vers des approches beaucoup plus ciblées. Vous allez découvrir quelles innovations sont en cours, comment elles pourraient changer la prescription d'ici les dix prochaines années, et quels obstacles restent à franchir.
Points clés
- Les antitussifs classiques sont limités par l’efficacité et les effets secondaires.
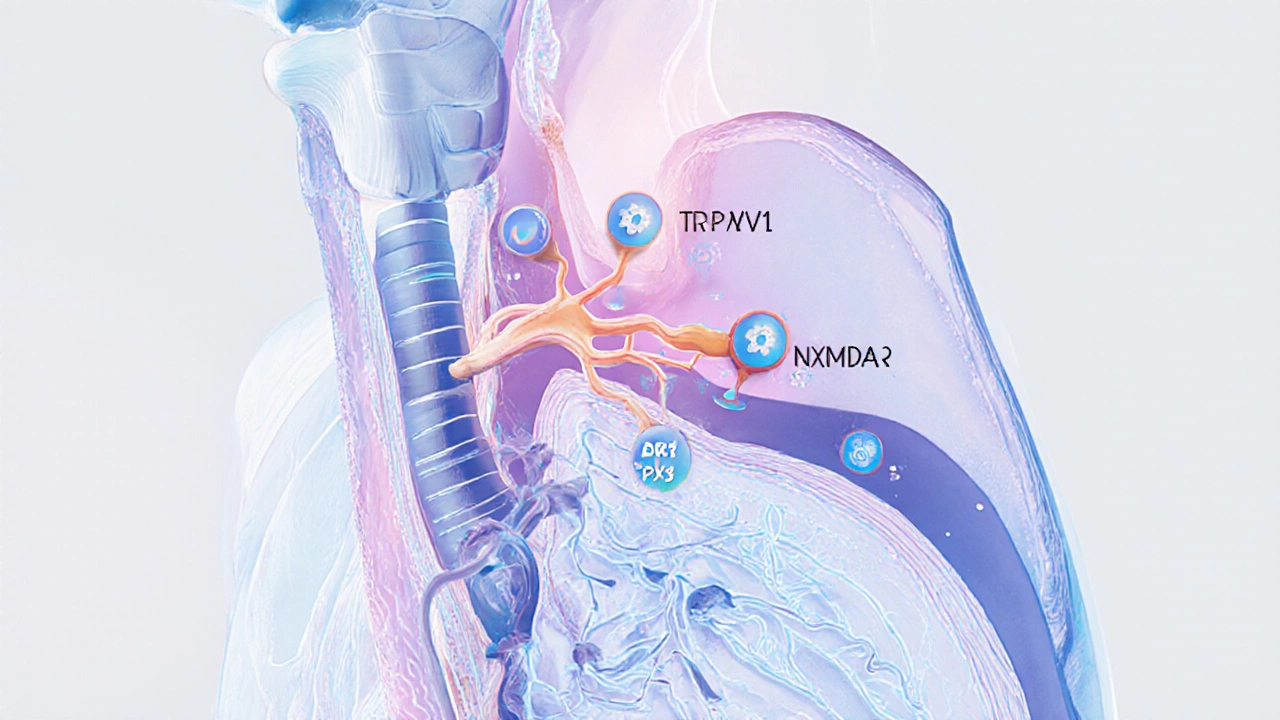
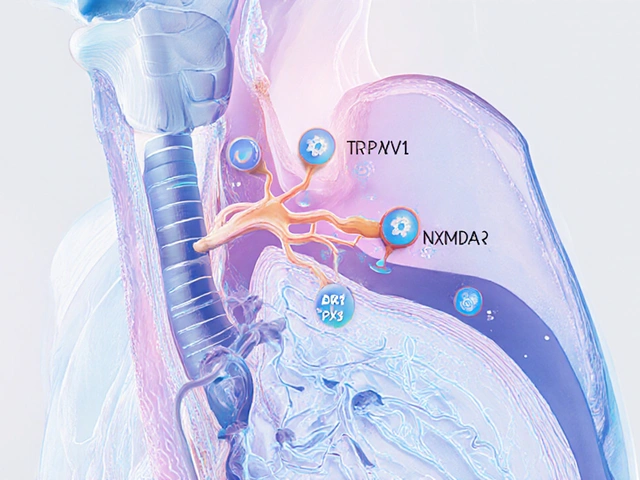
- Des cibles moléculaires comme les récepteurs NMDA ou les canaux TRPV1 ouvrent de nouvelles voies thérapeutiques.
- Les anticorps monoclonaux, la thérapie génique et les nanodoses sont déjà en essais cliniques.
- L’intelligence artificielle accélère la découverte de composés et la sélection des patients.
- Le microbiome respiratoire apparaît comme un facteur modifiable de la toux chronique.
Traitements actuels et leurs limites
Les antitussifs sont des molécules qui suppriment le centre de la toux dans le tronc cérébral - souvent des opioïdes faibles (codéine) ou des dérivés de la noscapine. Leur efficacité reste modeste, surtout quand la toux est due à une inflammation des voies aériennes. Les effets secondaires - sédation, constipation, risque de dépendance - limitent leur usage à court terme.
Les médicaments bronchodilatateurs et les corticostéroïdes, bien utiles pour les maladies obstructives, ne ciblent pas directement le réflexe de toux. Résultat: de nombreux patients restent insatisfaits, surtout ceux qui souffrent de toux chronique post‑virale ou de toux liée à la maladie pulmonaire interstitielle.
Nouvelles cibles moléculaires
Les avancées de la pharmacologie ont identifié plusieurs récepteurs clés. Le récepteur NMDA participe à la transmission du signal de toux dans le cerveau, et des antagonistes sélectifs sont en phase I/II d’essais. De même, les canaux ioniques TRPV1 et P2X3 sont exprimés dans les terminaisons nerveuses des voies respiratoires ; bloquer ces canaux diminue la sensibilité et la fréquence de la toux.
Ces molécules offrent l’avantage d’être plus spécifiques, donc moins d’effets systémiques. Les premiers résultats montrent une réduction de 30% à 50% du score de toux sans sédation notable.
Thérapies biologiques et géniques
Les anticorps monoclonaux ciblent des protéines impliquées dans l’inflammation ou la transmission nerveuse, comme le NGF (nerve growth factor). Un anticorps anti‑NGF testé chez des patients atteints de toux chronique post‑COVID a réduit la fréquence des crises de 40% en huit semaines.
La thérapie génique vise à corriger ou à moduler l’expression génétique des récepteurs responsables de la toux. Des vecteurs adéno‑associes délivrés par inhalation permettent d’éditer localement les gènes du système nerveux périphérique. Bien que la phase pre‑clinique soit prometteuse, la sécurité à long terme reste à confirmer.
Technologies émergentes : nanotechnologie et IA
Les nanoparticules de taille inférieure à 100nm peuvent transporter des médicaments directement sur les épithéliums bronchiques. En encapsulant des antagonistes de TRPV1, elles prolongent la libération jusqu’à 24h et réduisent les doses nécessaires.
L’intelligence artificielle analyse les bases de données de composés, les essais cliniques et les dossiers patients pour identifier des candidats prometteurs a déjà permis de sélectionner trois molécules qui sont maintenant en phase II. L’IA aide également à stratifier les patients selon des biomarqueurs respiratoires, ce qui rend les essais plus efficaces.

Le rôle du microbiome respiratoire
Des études récentes (2023‑2025) montrent que la composition du microbiome respiratoire influence la sensibilité des voies aériennes aux irritants et peut favoriser une toux persistante. Des probiotiques inhalés ou des transplantations de microbiote sont testés comme adjuvants aux traitements classiques. Les premiers résultats suggèrent une amélioration de la fonction mucociliaire et une diminution de la fréquence des toux nocturnes.
Comparaison des options thérapeutiques
| Catégorie | Mécanisme | Efficacité clinique | Effets secondaires majeurs | Statut réglementaire (2025) |
|---|---|---|---|---|
| Antitussifs opioïdes | Dépression du centre de la toux | 15‑30% de réduction du score de toux | Sédation, constipation, dépendance | Autorisé, usage limité |
| Antagonistes TRPV1 | Blocage des canaux sensoriels bronchiques | 30‑50% de réduction (essais II) | Rash cutané, toux aiguë rare | En cours d’évaluation |
| Anticorps anti‑NGF | Neutralisation du facteur de croissance nerveuse | ≈40% de réduction (post‑COVID) | Réactions immunitaires légères | Phase III, approbation attendue 2027 |
| Thérapie génique inhalée | Modification de l’expression des récepteurs de toux | Résultats pré‑cliniques >60% de suppression | Incertitude immunitaire à long terme | Phase I/II (2025) |
| Nanoparticules de libération prolongée | Transport ciblé de molécules anti‑toux | Durée d’action jusqu’à 24h | Peu d’effets rapportés | Prototype clinique |
| Probiotiques respiratoires | Modulation du microbiome bronchique | Amélioration symptomatique modeste | Aucun majeur connu | Essais pilotes |
Défis à surmonter
Malgré l’élan, plusieurs obstacles freinent le déploiement généralisé. La variabilité génétique des patients rend difficile la standardisation des dosages. De plus, la plupart des études cliniques sont encore de petite taille, souvent limitées à des populations post‑virales, ce qui complique la généralisation aux toux liées à l’asthme ou à la BPCO.
Réglementairement, les thérapies de pointe (génique, anticorps) exigent des procédures d’évaluation de sécurité longues et coûteuses. Les dispositifs d’inhalation nanotechnologique doivent aussi satisfaire des normes de biocompatibilité très strictes.
Ce que les praticiens peuvent anticiper d’ici 2030
- Un passage progressif des opioïdes vers des antagonistes de récepteurs plus sélectifs.
- L’intégration de tests de biomarqueurs (NGF, profil microbiome) dans la prescription.
- La disponibilité de formulations à libération prolongée, réduisant la fréquence d’administration.
- Un usage ciblé de l’IA pour personnaliser les schémas de traitement.
En pratique, le médecin pourra proposer, dès la prochaine décennie, un «circuit de soins de la toux»: diagnostics rapides, sélection d’une thérapie anti‑récepteur ou d’un anticorps selon le profil du patient, puis suivi par une application mobile qui ajuste la dose grâce à l’IA.
Checklist pratique pour les patients et les professionnels
- Évaluer la cause sous‑jacente: infection, allergie, maladie chronique.
- Mesurer le score de toux (échelle VAS ou CQLQ) pour suivre l’efficacité.
- Considérer un antagoniste de récepteur (TRPV1, P2X3) si les antitussifs classiques échouent.
- Vérifier la disponibilité d’essais cliniques locaux (registrations 2025‑2026).
- Surveiller les effets indésirables: somnolence, réactions cutanées, signes d’inflammation.
Foire aux questions
Les nouveaux antitussifs sont-ils sans risque d’accoutumance?
Les antagonistes ciblant les récepteurs sensoriels (TRPV1, P2X3) n’agissent pas sur les voies de récompense du cerveau, donc le risque de dépendance est quasiment nul. Les effets secondaires les plus courants sont légers (irritation locale, légère éruption cutanée).
Comment la nanotechnologie améliore-t-elle la prise de médicaments?
Les nanoparticules protègent le principe actif de la dégradation enzymatique et libèrent le médicament directement sur les cellules bronchiques. Cela permet de réduire la dose totale de 30‑50% tout en prolongeant la durée d’action jusqu’à 24heures.
L’intelligence artificielle remplace‑t‑elle le médecin?
Non. L’IA fournit surtout des recommandations basées sur de grands ensembles de données: elle aide le professionnel à choisir le meilleur traitement selon le profil génétique et le microbiome du patient, mais la décision finale reste médicale.
Quand les anticorps anti‑NGF seront‑ils disponibles?
Les premiers résultats de phase III sont attendus fin 2026. Si les données confirment l’efficacité et la sécurité, une autorisation de mise sur le marché pourrait arriver en 2027‑2028 en Europe et en Amérique du Nord.
Le microbiome peut‑il vraiment diminuer la toux chronique?
Les études de 2024‑2025 montrent que la réintroduction de bactéries bénéfiques (Streptococcus salivarius, Corynebacterium accolens) améliore la fonction mucociliaire et baisse le nombre de crises de toux nocturne d’environ 20%. Cependant, les preuves sont encore préliminaires et nécessitent de plus grands essais.
Sean Verny
Plongés au cœur d’une révolution thérapeutique, nous observons jadis les opioïdes céder la place à des molécules qui flirtent avec les récepteurs sensoriels comme des danseurs sur une toile d’argent. La synergie entre nanotechnologie et intelligence artificielle façonne une chorégraphie pharmacologique où chaque pas est mesuré avec la précision d’un horloger suisse. Imaginez un antitussif qui, tel un chef d’orchestre, module la toux sans étouffer la conscience ni installer la dépendance. Ce tableau se teinte de nuances vibrantes, où le microbiome respiratoire devient le prélude d’une mélodie de guérison. Ainsi, l’avenir des traitements anti‑toux s’inscrit comme un poème vivant, où chaque verbe scientifique résonne comme une note d’espoir.
Joelle Lefort
C’est scandaleux que la société accepte encore les opioïdes alors qu’on possède des alternatives plus sûres.
Fabien Gouyon
Alors que les chercheurs débattent, les données s’accumulent, les essais cliniques avancent, et les patients attendent… 🌟 les nouvelles molécules ciblant TRPV1 offrent déjà des résultats prometteurs, même si l’innovatoin comporte des défis, il faut souligner la réduction dramatique des effets secondaires, et surtout, la tolérance accrue chez les jeunes, voilà un vrai pas en avant! 😃
Jean-Luc DELMESTRE
Le futur des antitussifs se dessine sous nos yeux comme une aube nouvelle. Les anciennes molécules peinent à répondre aux attentes cliniques. Les récepteurs sensoriels offrent une porte d’entrée plus précise. Les essais de phase II montrent des baisses de toux significatives. Les patients rapportent moins de somnolence. Les formulations nanotechnologiques prolongent la durée d’action. L’intelligence artificielle accélère la découverte de composés. Les données génomiques permettent une médecine personnalisée. Le microbiome respiratoire apparaît comme un facteur modulable. Les probiotiques inhalés réduisent les crises nocturnes. Les anticorps anti‑NGF ouvrent une voie immunologique. La thérapie génique promet une correction durable. Les réglementations restent un obstacle majeur. Les coûts de production devront être maîtrisés. L’adhésion des cliniciens est essentielle. En somme, la médecine de la toux évolue vers une ère plus ciblée et plus sûre.
philippe DOREY
Il est temps que la communauté médicale bannisse les opioïdes comme on bannit les mauvaises habitudes, car la santé publique ne doit pas être sacrifiée sur l’autel de la facilité. Les nouvelles cibles comme TRPV1 et P2X3 sont la preuve que l’innovation peut rimer avec responsabilité. Ensemble, nous devons pousser pour une adoption rapide afin de sauver des vies.
Benoit Vlaminck
Excellent vision, cela donne vraiment envie de suivre ces avancées.
Cédric Adam
On ne peut plus tolérer que la France reste à la traîne pendant que d’autres pays adoptent ces thérapies modernes, il faut que nos laboratoires investissent massivement dès maintenant.
Eveline Erdei
c'est absolument inacceptable la paresse de nos décideurs, ils laissent passer l'innovation pendant que les patients souffrent.
Anthony Fournier
En observant les tendances, on remarque que les essais cliniques adoptent des critères de sélection plus stricts, que les biomarqueurs deviennent indispensables, et que les patients bénéficient d’une prise en charge plus individualisée, ce qui est très encourageant.
Anne Vial
Bah, ça a l'air bien, mais on verra bien si ça tient la route :)
catherine scelles
Quel bonheur de voir la science transformer la toux en simple problème technique à résoudre, avec des nanoparticules qui ciblent le théâtre bronchique comme des artistes de cirque, et des IA qui prédisent le meilleur cocktail moléculaire. C’est un vrai feu d’artifice d’innovation qui illumine l’avenir des patients!
Adrien de SADE
Il convient de souligner, avec une rigueur académique, que la convergence des disciplines pharmacologiques et biotechnologiques représente une synergie sans précédent, bien que certains critiques, souvent peu informés, sous‑estiment l’impact potentiel de ces thérapies de pointe.
rene de paula jr
From a pharmacodynamic standpoint, the ligand‑receptor affinity modulation exhibited by TRPV1 antagonists constitutes a paradigm shift, optimizing both efficacy and safety profiles; moreover, the integration of ML‑driven compound screening accelerates lead identification significantly. 📈
Valerie Grimm
Je trouve que le texte est bien écrit, mais attention aux petites coquilles comme « antitussif » avec un « s » en trop, ça arrive facilement quand on tape vite.
Francine Azel
Ah, l’ironie du temps où l’on passe des antidotes à la dépendance à des anticorps qui, au final, nous rappellent que la nature sait mieux que nous, n’est‑ce pas une belle leçon d’humilité?
Vincent Bony
Oui, parce que rien ne vaut mieux que de laisser des nanotechnologies jouer les sauveurs pendant que les médecins restent sur leurs vieux dossiers, n’est‑ce pas génial ?
bachir hssn
Si l’on veut parler d’innovation réelle il faut dépasser le buzz des nanoparticules et viser une vraie maîtrise génétique plutôt que de rester bloqués dans des essais de phase II superficiels
Marion Olszewski
En résumé, les avancées décrites offrent des perspectives prometteuses ; toutefois, il reste crucial d’évaluer les effets à long terme, de standardiser les protocoles d’administration, et de garantir l’accessibilité pour tous les patients concernés.